No podrás conectarte si excedes diez intentos fallidos.
La Agencia SINC ofrece servicios diferentes dependiendo de tu perfil.
Selecciona el tuyo:
Investigadores del CNIO han conseguido destruir las células tumorales de sarcoma de Ewing y leucemia mieloide crónica cortando mediante CRISPR Cas9 los genes de fusión causantes de estos tumores. El estudio se ha llevado a cabo en roedores.
Esta semana las investigadoras Jennifer Doudna y Emmanuelle Charpentier han sido galardonadas con el Premio Nobel de Química 2020 por el desarrollo de las tijeras moleculares CRISPR Cas9, uno de los enfoques más prometedores para el avance de los tratamientos contra las enfermedades genéticas, entre ellas el cáncer.
Ahora, la Unidad de Citogenética Molecular que dirige Sandra Rodríguez-Perales en el Centro Nacional de Investigaciones Oncológicas (CNIO) ha dado un paso más para poder aplicar eficazmente esta tecnología para la eliminación de los llamados genes de fusión, lo que en un futuro podría abrir las puertas al desarrollo de terapias oncológicas que eliminen específicamente los tumores sin afectar a las células sanas. El trabajo se publica en Nature Communications.
Los genes de fusión son el resultado aberrante de la unión errónea de fragmentos de ADN que proceden de dos genes diferentes, una alteración que ocurre por azar durante el proceso de división celular. Si la célula no puede sacar ningún provecho del error, las células portadoras morirán y estos genes serán eliminados.
Pero cuando confieren una ventaja proliferativa o de supervivencia, la célula portadora se multiplica y los genes de fusión y las proteínas que codifican se convierten, así, en el evento iniciador de un cáncer. “Muchos reordenamientos cromosómicos y los genes de fusión que producen son el origen de sarcomas y leucemias infantiles”, explica Rodríguez-Perales, coautora principal del estudio. También se encuentran en tumores de próstata, mama, pulmón o cerebrales, entre otros: en total, hasta en un 20% de todos los cánceres.
Debido a que solo están presentes en células tumorales, los genes de fusión despiertan un gran interés en la comunidad científica, para convertirlos en dianas terapéuticas altamente específicas, de tal manera que únicamente actúen sobre el tumor y no produzcan efectos en las células sanas.
Y aquí entra CRISPR. Mediante esta tecnología, los investigadores pueden dirigirse a secuencias concretas del genoma y, como si estuvieran utilizando unas tijeras moleculares, cortar y pegar fragmentos de ADN y así modificar el genoma de manera controlada. En el estudio que ha llevado a cabo el equipo del CNIO, los investigadores han trabajado con líneas celulares y modelos de ratón de sarcoma de Ewing y leucemia mieloide crónica, en los que han conseguido eliminar las células tumorales cortando los genes de fusión, inicio del tumor.
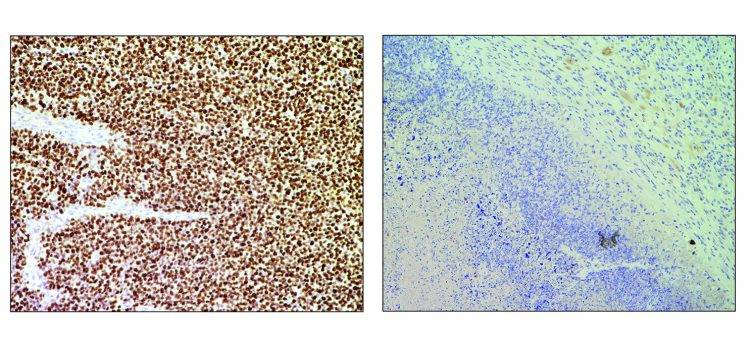
Pixabay Imágenes representativas de un tumor no tratado (izquierda) comparado con otro tumor tratado (derecha) con el sistema de edición génetica CRISPR Cas9para la eliminación de genes de fusión.
Es la primera vez que se tiene éxito aplicando CRISPR para la eliminación selectiva de genes de fusión en células tumorales. Estrategias previas de otros equipos de investigación se basan en modificar el punto de unión de los dos genes implicados en la fusión para introducir una secuencia de ADN que induzca la muerte celular. El problema es que la introducción de secuencias externas ha demostrado ser muy poco eficaz para eliminar tumores.
Los investigadores del CNIO han utilizado otra aproximación totalmente distinta para inducir que la célula tumoral se autodestruya. “Nuestra estrategia ha consistido en hacer dos cortes en intrones, regiones no codificantes del gen, localizados a ambos extremos del gen de fusión”, explica Raúl Torres-Ruiz, coautor del trabajo. “De este modo, la célula al intentar reparar por sí sola esas roturas, unirá los extremos cortados produciendo la eliminación completa del gen de fusión que se localiza en medio”. Como este gen es esencial para su supervivencia, esta reparación induce automáticamente la muerte de la célula tumoral.
“En próximos pasos, seguiremos haciendo estudios para analizar la seguridad y eficiencia de nuestra aproximación”, continúa Rodríguez-Perales. “Estos pasos son indispensables para conocer si nuestra aproximación podría ser trasladable en un futuro a un potencial tratamiento clínico. Además, estudiar si nuestra estrategia, que ya hemos visto que funciona en sarcoma de Ewing y leucemia mieloide crónica, también es efectiva en otros tipos de cáncer causados por genes de fusión y para los que ahora mismo no hay terapias eficaces”, concluye.
El trabajo ha sido financiado por el Ministerio de Ciencia e Innovación, el Instituto de Salud Carlos III, el Fondo Europeo de Desarrollo Regional, la Asociación Española Contra el Cáncer (AECC), el European Research Council, la Generalitat de Catalunya, la Red de Terapia Celular, FERO, la Fundación “la Caixa”, la Fundaciò Josep Carreras y la Xarxa de Bancs de Tumors de Catalunya.
Referencia:
Marta Martínez-Lage et a. “In vivo CRISPR/Cas9 targeting of fusion oncogenes for selective elimination of cancer cells”. Nature Communications, 2020 DOI: 10.1038/s41467-020-18875-x